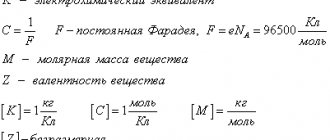4.7
Средняя оценка: 4.7
Всего получено оценок: 299.
4.7
Средняя оценка: 4.7
Всего получено оценок: 299.
Электролиты – вещества, растворы или расплавы которых способны проводить электричество. Движение электрического тока в электролитах называется электролизом.
Передача электричества
Электрический ток – это упорядоченное движение заряженных частиц. Носителями заряда электрического тока в электролитах являются ионы. Они образуются в результате распада (электролитической диссоциации) молекул вещества под действием молекул воды в растворе или при нагревании и образовании расплава.
Расщепление молекул происходит за счёт разрыва полярных ковалентных или ионных связей. Интенсивность диссоциации зависит от температуры и концентрации раствора. Также на степень диссоциации влияет природа электролита. В связи с этим выделяют:
- слабые электролиты, распадающиеся частично или не распадающиеся вообще;
- сильные электролиты, быстро распадающиеся на ионы.
К слабым электролитам относится большинство органических веществ, слабые кислоты, плохо растворимые соли и нерастворимые основания. Сильные кислоты, щёлочи, соли относятся к сильным электролитам.
Рис. 1. Процесс электролитической диссоциации.
Образованные в результате диссоциации ионы делятся на два типа:
- катионы – положительно заряженные частицы;
- анионы – отрицательно заряженные частицы.
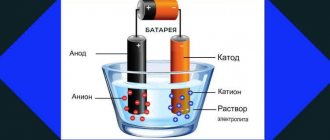
Проводником электрического тока в электролитах является электрод. Он может быть анодом или катодом. Анод присоединён к положительному полюсу источника тока, катод – к отрицательному. Анод окисляет вещества, находящиеся в электролите, катод – восстанавливает.
Рис. 2. Электроды.
Если в раствор электролита поместить два электрода – катод и анод – и включить электрический ток, то ионы начнут двигаться под действием электрического поля. Катионы устремятся к катоду, анионы – к аноду. Достигнув электродов, ионы нейтрализуются, превращаются в нейтральные атомы и оседают.
Процесс разложения вещества на составные части, которые оседают на электродах, называется электролизом.
1.15. Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
| SO4 + Cu = CuSO4. |
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
| Рисунок 1.15.1. Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
| m = kQ = kIt. |
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m0 и q0 – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея.
| F = eNA = 96485 Кл / моль. |
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Закон Фарадея
Процесс электролиза экспериментально изучил английский физик и химик Майкл Фарадей в 1833 году. Он сформулировал закон, согласно которому масса выделившегося на электроде вещества прямо пропорциональна прошедшему через электролит заряду. Этот закон закрепился в науке как первый закон Фарадея.
Рис. 3. Майкл Фарадей.
m = kQ = kIt,
где:
- m – масса вещества;
- Q – заряд;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время действия тока.
Согласно второму закону Фарадея масса выделившегося на электроды вещества прямо пропорциональна отношению молярной массы к валентности и равна электрохимическому эквиваленту.
m = k = M/z,
где:
- m – масса выделившегося вещества;
- k – электрохимический эквивалент;
- M – молярная масса;
- z – валентность вещества.
Электролиз используется в щелочных и кислотных аккумуляторах. С помощью электролиза можно защитить изделие металлическим покрытием.
Передача электротока
Электроток представляет собой упорядоченное движение свободных зарядов. Чтобы выяснить, как электрический ток проводится в растворах, следует понять, какие частицы являются его носителями. В твердых телах ток создается электронами. Носителями электрического тока в электролитах являются ионы. Эти частицы образуются в результате процесса распада (электрической диссоциации) молекул вещества под воздействием воды в растворах либо при нагревании и последующем появлении расплава.
Молекулы веществ распадаются благодаря разрыву ионных либо полярных ковалентных связей. Количество носителей заряда в электролите определяют концентрация и температура. Кроме того, степень распада молекул зависит от природы электролита. В результате они делятся на две группы:
- слабые — не подвержены распаду либо этот процесс протекает крайне медленно;
- сильные — в таких электролитах наблюдается быстрое расщепление молекул на ионы.
К первой группе принадлежит большая часть органических веществ — нерастворимые основания, слабые кислоты и плохо растворимые соли. Сильными электролитами являются щелочи, сильные кислоты и хорошо растворимые соли.
Электрический ток в жидкостях. Закон электролиза
Во всех ранее рассмотренных нами случаях перенос заряда не сопровождался переносом вещества. Но существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Такими проводниками являются растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов. Эти вещества называют электролитами.
Чтобы понять природу электрического тока в электролитах, соберём электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с дистиллированной водой, в которой находятся два угольных электрода. Замкнём цепь. Лампочка не светится. Следовательно, дистиллированная вода является диэлектриком.
Давайте повторим опыт, предварительно растворив в дистиллированной воде сахар. Лампа не светится и в этом случае. Значит, раствор сахара в воде тоже является диэлектриком.
А теперь растворим в дистиллированной воде небольшое количество соли, например, хлорида меди и повторим опыт. Как видим, в цепи проходит электрический ток, о чём наглядно свидетельствует свечение лампы. Вывод напрашивается сам собой: раствор соли в воде является проводником электрического тока.
При изучении химии вы узнали, что при растворении солей, кислот и щелочей в воде происходит электролитическая диссоциация, то есть распад молекул электролита на ионы.
В проведённом опыте хлорид меди в водном растворе диссоциирует на положительно заряженные ионы меди и отрицательно заряженные ионы хлора, которые при отсутствии электрического поля движутся хаотически:
Однако, стоит создать внешнее электрическое поле, как на хаотическое движение частиц накладывается направленное движение положительно и отрицательно заряженных ионов. При этом положительно заряженные ионы меди движутся к электроду, подключённому к отрицательному полюсу источника тока (то есть к катоду), а отрицательно заряженные ионы хлора — к положительному аноду. На аноде будет происходить процесс окисления ионов хлора до атомов хлора: Cl– – e
– = Cl. А нейтральные атомы хлора будут образовывать молекулы хлора, который выделяется на аноде: Cl + Cl = Cl2↑.
На катоде же будет происходить процесс восстановления ионов меди до нейтральных атомов и осаждение металлической меди (о чём и свидетельствует бурый налёт на катоде): Cu2+ + 2e
– = Cu.
Таким образом, свободными носителями электрического заряда в электролитах являются положительно и отрицательно заряженные ионы, образующиеся в результате электролитической диссоциации. Следовательно, проводимость электролитов является ионной.
Давайте изучим сопротивление электролитов. Для этого соберём простую электрическую цепь, состоящую из источника тока, электролитической ванны и амперметра. Поддерживая постоянное напряжение между электродами, приблизим их друг к другу. Нетрудно заметить, что амперметр показывает увеличение силы тока в цепи.
Теперь установим один из электродов так, чтобы его часть выступала над поверхностью раствора, — показания амперметра уменьшились.
Таким образом, при уменьшении расстояния между электродами и площади перекрытия электродов, сопротивление электролита уменьшается.
А сейчас давайте нагреем электролит. Как видим, с ростом температуры показания амперметра увеличиваться. Следовательно, увеличение температуры электролита ведёт к уменьшению его сопротивления.
Теперь давайте будем увеличивать напряжение между электродами в целое число раз. Не трудно заметить, что показания амперметра в этом случае также увеличиваются в целое число раз, пропорционально напряжению. Это свидетельствует о том, что для электролитов выполняется закон Ома:
Отметим также тот факт, что при прохождении электрического тока через электролит проявляется тепловое действие тока, то есть выполняется закон Джоуля—Ленца:
Идём дальше. При изучении химии вы узнали, что процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, протекающими при прохождении электрического тока через растворы (расплавы) электролитов, называют электролизом.
Первый закон электролиза был экспериментально установлен Фарадеем в 1833 году. Согласно ему, масса вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит:
m
=
kq
.
Коэффициент пропорциональности k
в формуле называют
электрохимическим эквивалентом данного вещества. Он численно равен массе вещества, выделившегося на одном из электродов при прохождении через электролит единичного электрического заряда.
В СИ электрохимический эквивалент измеряют в килограммах на кулон: [k
] = [Кл/кг].
Но вернёмся к первому закону электролиза и вспомним, что заряд, прошедший через поперечное сечение проводника (в нашем случае, через раствор электролита) за единицу времени, можно найти, как произведение силы тока на время его прохождения: q
=
It
.
Массу вещества, выделившегося на электроде при прохождении через электролит электрического заряда, можно определить, зная массу одного иона и число осевших на этом электроде ионов: m
=
m
0
N
.
А массу одного иона легко найти, зная молярную массу вещества и число Авогадро:
Выразим из последних двух формул число ионов:
Теперь вспомним, это же число ионов мы можем определить, как отношение заряда, прошедшего через электролит, к заряду одного иона, который кратен элементарному заряду:
В записанной формуле n
— это валентность иона.
Прировняв правые части последних двух равенств, найдём массу выделившегося на катоде вещества.
Сравнивая полученное выражение с первым законом электролиза легко получить формулу для определения электрохимического эквивалента вещества:
Произведение двух универсальных постоянных называют постоянной Фарадея:
А отношение молярной массы вещества к валентности иона называют химическим эквивалентом вещества:
Отсюда вытекает второй закон Фарадея для электролиза: электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам:
А теперь давайте подставим выражение для электрохимического эквивалента вещества в первый закон электролиза:
Полученное выражение называют объединённым законом Фарадея для электролиза.
Согласно этому закону
масса вещества, выделившегося на каждом из электродов, пропорциональна молярной массе ионов этого вещества, силе тока и времени его прохождения через электролит и обратно пропорциональна валентности ионов вещества.
Используя закон электролиза, можно определить значение заряда электрона:
В 1874 году именно таким путём и было впервые получено значение элементарного электрического заряда.
А теперь, для закрепления материала решим с вами такую задачу. Хромирование тонкой прямоугольной пластинки размерами а
= 5,0 см и
b
= 8,0 см в большой гальванической ванне осуществляется в течение трёх часов при силе тока 1,5 А. Определите толщину образовавшегося на пластинке слоя хрома.
В заключении урока отметим, что электролиз нашёл широкое применения в технике. Так, например, английский химик и один из основателей электрометаллургии сэр Гемфри Дэви разработал методику получения металлов с наименьшим количеством примесей.
С помощью электролиза наносят защитные и декоративные покрытия на металлические изделия (это называется гальваностегией).
В 1836 году русский академик Борис Семёнович Якоби разработал метод для производства идеальных копий исходного предмета. Его назвали гальвванопластикой.
Первым изделием, полученным с помощью гальванотехники, стала монета. Якоби сначала использовал монету для получения матрицы-негатива, а с неё создал копию, находящейся в обороте, монеты. Осознав, что он открыл новый метод фальшивомонетничества, учёный уничтожил полученное изделие. Технология быстро распространилась в Российской империи. В частности, таким способом были созданы скульптуры на нефах Исаакиевского собора в Санкт-Петербурге.
С помощью электролиза также получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые краской участки медного слоя. После этого краска смывается, и на плате появляются детали микросхемы.
Электрическая диссоциация
Это основополагающий процесс для появления электротока в растворах, поэтому его необходимо рассмотреть более подробно. Все ионы, образующиеся при распаде молекул, можно разделить на 2 типа:
- Анионы. Имеют отрицательный заряд.
- Катионы. Обладают положительным зарядом.
Большинство свойств воды обусловлено полярностью молекул вещества. Говоря иначе, с точки зрения электротехники они являются диполями. Здесь следует вспомнить определение диполи — это система двух частиц, расположенных близко друг к другу. При этом их заряды противоположны по знаку, но одинаковы по модулю. Свойство полярности H2O объясняется геометрическим строением молекул вещества:
- угол между центральными линиями атомов равен примерно 104,5 градуса;
- электронны смещены в направлении кислорода.
Являясь диполями, молекулы воды способны создавать вокруг себя электрополе, которое воздействует не только на них, но и на частицы растворенного вещества.
Чтобы установить, какова природа процесса распада молекул на ионы, следует рассмотреть раствор поваренной соли. На внешней орбите атома натрия расположен лишь 1 электрон. Его связь с атомом слаба, поэтому он способен быстро уйти со своего места. У атома хлора на внешней орбите находится уже 7 электронов и до комплекта не хватает одной частицы. Благодаря этому при образовании кристалла NaCl внешний электрон натрия присоединяется к атому хлора. В итоге образуется диполь.
Взаимодействие двух видов диполей и способствуют активизации процесса растворения. Если в раствор электролита поместить 2 электрода — катод (отрицательный) и анод (положительный), то свободные ионы устремятся к ним. При этом направление их движения протекает по конкретным правилам:
- катионы направятся к катоду;
- анионы начинают двигаться в направлении анода.
Как только переносчики электротока достигают электродов, они теряют свой заряд, превращаясь в нейтральные, и оседают на поверхности электродов.